Первый и второй закон термодинамики, Второе начало термодинамики — Википедия
Вечные двигатели второго рода, превращающие тёплую воду в электрический ток и кубики льда, запрещены вторым законом термодинамики. Он утверждает, что. Процесс A Расширение в вакуум.
Количество теплоты , необходимое для перехода из первого состояния во второе, также будет зависеть от вида кривой формы траектории. В этом можно убедится, если учесть тот факт, что внутренняя энергия является функцией состояния термодинамической системы, и ее изменение при переходе из первого состояния во второе не зависит от пути этого перехода.
А, следовательно, в соответствии с первым началом термодинамики см. Задача 1. Найти работу, совершаемую газом, при его расширении от объема до объема , если зависимость давления от объема выражается формулой: , где и - известные константы. Решение: В соответствии с формулой 1.
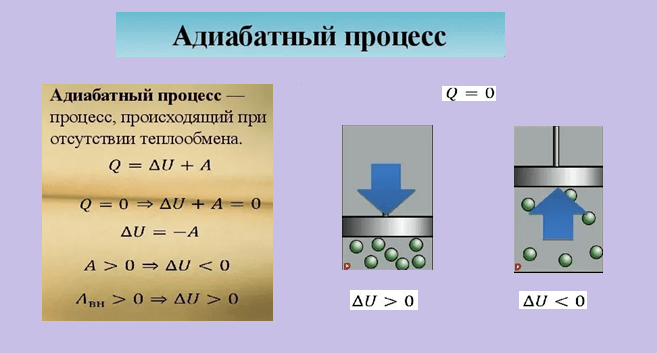
МГТУ им. Баумана Designed by krE[]Sote. ГЛАВА 1. Первое начало термодинамики Первое начало термодинамики утверждает, что изменение внутренней энергии термодинамической системы тела может быть осуществлено двумя путями: путём совершения механической работы и путём теплопередачи. Таким образом, количество теплоты может быть определено как разность изменения внутренней энергии системы и механической работы, совершённой над системой: ,.
Как вы видите, всё сходится. Если посмотреть с другой стороны, связь менее очевидна. Предположим, что о некотором стакане воды вы изначально знали только то, что его температура составляла 72 градуса. Затем, внезапно, Святой Лаплас раскрывает вам точные координаты и скорости всех атомов в воде. Теперь вы прекрасно знаете состояние воды, поэтому, по определению информационной энтропии, её энтропия равна нулю.

Делает ли это его термодинамическую энтропию нулевой? Будет ли вода холоднее из-за нашего знания? Максвелл однажды спросил: «Почему мы не можем взять сосуд с равномерно распределённым горячим газом, разделить его перегородкой на две части — A и B, и сделать так, чтобы из В в А переходили только быстрые молекулы, а из А в В — только медленные? Если построить такой разделитель, то на стороне А мы получим горячий газ, а на стороне В — холодный. Мы тогда смогли бы дёшево охлаждать продукты, верно?
Агент, который проверяет каждую молекулу газа и решает, пропускать ли её, известен под именем «демон Максвелла». И причина, по которой вы не можете построить эффективный холодильник таким образом, заключается в том, что демон Максвелла генерирует энтропию, когда проверяет скорости молекул газа и решает, пропускать молекулу или нет. Тогда вы действительно можете запустить демона Максвелла и извлечь из этого полезную работу. Поэтому опять же игнорируя квантовые эффекты на данный момент , если вы знаете состояния всех молекул в стакане горячей воды, в истинно термодинамическом смысле он холодный: вы можете забрать электричество из воды и оставить кубик льда.
Физический процесс просто преобразует «холодность» негэнтропию общей информации, чтобы сделать холодной настоящую воду. Как видите, всё в порядке! И не говорите мне, что знание «субъективно». Знание представлено в мозге, и это делает его таким же физическим, как и всё остальное. Вы можете воспользоваться этим термодинамическим преимуществом - оно называется двигателем Сцилларда.
И наоборот, одна подсистема не может увеличить общую информацию с другой подсистемой, без 1 взаимодействия с ней и без 2 выполнения термодинамической работы.
В противном случае, вы могли бы создать демона Максвелла и нарушить второй закон термодинамики, что, в свою очередь, нарушило бы теорему Лиувилля, а это невозможно в стандартной модели физики. Таким образом, чтобы сформировать точные убеждения о чём-то, вам совершенно необходимо за этим наблюдать. Это очень физический, очень реальный процесс: любой рациональный разум «работает» в термодинамическом смысле, а не только в смысле умственных усилий.
Иногда говорят, что термодинамическая работа требуется для стирания битов при подготовке к новому наблюдению, но это различие — всего лишь вопрос терминов, математика процесса однозначна. Здесь я пока не буду рассматривать вопрос открытия логических «истин» — в некоторой степени потому, что я пока размышляю, как это точно формализовать. В термодинамике знание логических истин не считается негэнтропией, как можно было бы ожидать, поскольку компьютер, способный выполнять обратимые вычисления, смог бы вычислять логические истины с любыми произвольно низкими затратами.
Вышенаписанное относится к разуму, который знает о логике всё.
Любой более простой ум обязательно будет менее эффективным. Если бы слепая вера действительно работала как метод исследования, вы могли бы превратить тёплую воду в электричество и кубики льда.

Просто создайте Демона Максвелла, который слепо верит в точные значения скоростей молекул. Двигатели познания не так сильно отличаются от тепловых двигателей, хоть они и манипулируют энтропией более тонким образом, чем сжигание бензина.
Например, они схожи тем, что двигатели познания не являются абсолютно эффективными, они должны излучать лишнее тепло, как его излучает двигатель автомобиля или холодильник. Фраза «холодная рациональность» правдива в таком смысле, о котором голливудские сценаристы даже не могли и подумать и неверна в том смысле, который они имели в виду.
Поэтому, если вы не можете сказать мне, какой именно шаг в вашем рассуждении нарушает законы физики, давая вам истинное знание незримого, то не ожидайте, что я поверю в то, что всё сложное умное рассуждение способно их нарушить. Элиезер Юдковский. Гельмгольца , который — не зная о работах Майера — распространил закон сохранения энергии на все её виды и сыграл решающую роль в том, что этот закон стал общепризнанным [5].

Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя перпетуум мобиле первого рода, который совершал бы работу, не черпая энергию из какого-либо источника [1] [2] [3]. Связь этого утверждения с законом сохранения энергии самоочевидна.
Переход от микроскопического описания системы к макроскопическому ведёт к радикальному сокращению числа физических величин, необходимых для описания системы.
Поэтому в термодинамике энергетические превращения — подчас весьма сложные, — происходящие внутри системы на микроуровне, не детализируют [6] , а совокупно описывают посредством специально для этой цели вводимой макроскопической величины — внутренней энергии , составной части полной энергии системы, с микроскопической точки зрения представляющей собой сумму энергий всех входящих в систему частиц [7]. По этой причине в тех учебниках, в которых не касаются вопросов термодинамики потока и неравновесной термодинамики, нередко формулируют первое начало как постулат, вводящий в физику макроскопических систем представление о внутренней энергии [2] как об аддитивной величине [8] [9] , являющейся однозначной, непрерывной и конечной скалярной функцией состояния термодинамической системы [10].
Математическое выражение , служащее дефиницией внутренней энергии, зависит от выбора термодинамических величин , используемых в качестве независимых переменных теории. Традиционно внутреннюю энергию выражают с использованием в качестве фундаментальных понятий, которым термодинамика даёт описание без дефиниций, теплоту и термодинамическую работу [1] [3] заимствуя понятие работы из других разделов физики [15] [16]. Согласно Г. Из первого начала в формулировке Кирхгофа вытекает, что те составные части полной энергии системы, которые не изменяются в рассматриваем процессе, во внутреннюю энергию системы не входят и, следовательно, внутренняя энергия есть изменяемая часть полной энергии системы.
Для функции состояния естественен вопрос о её аргументах. Из дефиниции Кирхгофа следует, что внутренняя энергия зависит от переменных, входящих в выражение для работы, то есть обобщённых термодинамических координат , и температуры как движущей силы теплопередачи.
Традиционно теплоту и работу трактуют как формы передачи энергии, то есть их характеризуют посредством описательных дефиниций. Именно по этой причине как математические объекты теплота и работа в дефиницию внутренней энергии по Кирхгофу входят в виде неопределяемых переменных.
Давать дефиницию фундаментальной физической величине — энергии — посредством величин менее фундаментальных — теплоты и работы — есть методологический недостаток подхода Кирхгофа.
Наконец, в формулировке Кирхгофа внутренняя энергия как функция состояния привязана к функциям процесса — теплоте и работе. Фактически это означает привязку внутренней энергии к равновесным процессам в закрытых системах, когда возможна однозначная трактовка понятий теплоты и работы.
Важно, что ни масса системы, ни массы количества составляющих систему веществ не относятся к обобщённым термодинамическим координатам, а поэтому в традиционном подходе к обоснованию термодинамики массы количества веществ не входят в перечень переменных, от которых зависит внутренняя энергия или, что то же самое, масса является адиабатно заторможенной величиной [27].

Из аддитивности внутренней энергии вытекает, однако, что для флюидов газов и жидкостей внутренняя энергия обладает свойством экстенсивности , то есть внутренняя энергия однородной системы пропорциональна массе этой системы. Если же учесть, что масса системы равна сумме масс составляющих систему веществ, то становится понятным, что, во-первых, массы количества веществ могут входить в формулы термодинамики закрытых систем, и что, во-вторых, в эти формулы например, в выражения для удельной теплоёмкости и других удельных величин массы количества веществ входят не как переменные состояния, а в качестве числовых параметров , детализирующих характеристики конкретных систем.
Из сказанного следует, что термодинамическое описание открытых систем постоянного состава ничем не отличается от описания свойств закрытых систем [28]. Для открытых систем переменного состава, с которыми имеют дело в химической термодинамике , первое начало формулируют в виде аксиомы о существовании внутренней энергии как функции состояния, в перечень постулируемых свойств которой входит её функциональная зависимость от масс составляющих систему веществ [29] [26] [30] [31].
Так, К. В формулировке Каратеодори внутренняя энергия не представляет собой характеристическую функцию своих независимых переменных.