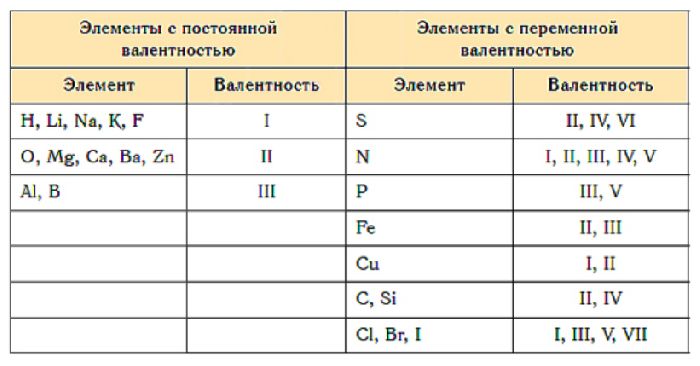
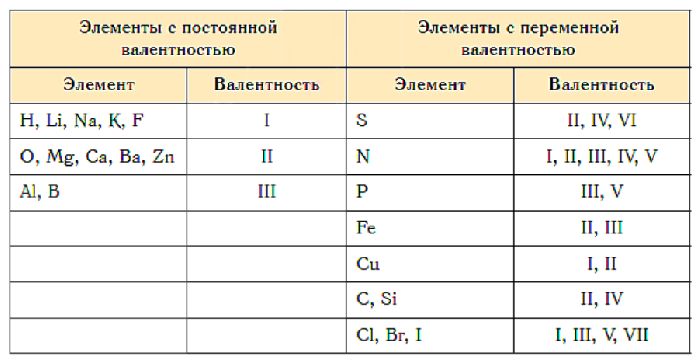
Валентности элементов таблица
Металлы — вещества, обладающие металлическими свойствами, такими как высокие электро- и теплопроводность, высокая пластичность, ковкость и характерный металлический блеск. Пример 1. По соседству с алмазом в его химическом пространстве. Коротко о главном Валентность — число ковалентных химических связей, которые атом образует с другими атомами. Образование связи в катионе аммония по донорно-акцепторному механизму.
При химических реакциях происходит разрыв одних и образование других химических связей. Валентные электроны при этом часто переходят от одного атома к другому.
Это происходит, например, при образовании хлорида натрия по реакции натрия с хлором:. На одном из этапов этой реакции атомы натрия отдают электроны, а атомы хлора их принимают, то есть происходит переход электронов от атомов натрия к атомам хлора с образованием ионов:.
Эти процессы носят названия " окисление" и " восстановление". Окисление - процесс, при котором атомы теряют электроны. Восстановление - процесс, при котором атомы принимают электроны.
Натрий при образовании хлорида натрия окисляется теряет электроны , а хлор восстанавливается принимает электроны. При этом хлор является окислителем , а натрий - восстановителем.
Но не всегда электроны при химических реакциях полностью переходят от одного атома к другому. Например, при образовании воды из водорода и кислорода. Можно дать два определения этой величины. Итак, степень окисления - это условный заряд атома условие - в определении. Определим степени окисления атомов в молекуле воды. При этом для указания, к какому из атомов мы в соответствии с определением полностью сместим электроны, будем использовать круглые скобки:.
Точно так же можно определить степени окисления атомов в молекуле пероксида водорода H 2 O 2 , но здесь электроны неполярной связи О-O нужно разделить между атомами кислорода:. В бинарных ионных соединениях все связи между атомами ионные, и, следовательно, степени окисления атомов равны зарядам их простых ионов.
Высшая степень окисления атома элемента равна номеру группы, в которой находятся данный элемент в системе элементов. Это следует из того, что атом может отдать полностью или частично только свои валентные электроны, а их число у него как раз и равно номеру группы. Низшая степень окисления атома элемента равна номеру группы минус 8 и не может быть по абсолютной величине больше четырех.
Это связано с тем, что атом может принимать электроны полностью или частично только на валентные подуровни, стремясь дополнить свою электронную конфигурацию до конфигурации благородного газа.
Зная степени окисления атомов и помня о электронейтральности веществ, легко составлять простейшие формулы соединений, даже не зная, каков в них характер химических связей ограничение: все атомы каждого из элементов должны быть в одной и той же степени окисления. Если в сложном веществе известны степени окисления атомов всех элементов кроме одного, то, зная формулу этого соединения простейшую или молекулярную , можно определить степень окисления атомов и последнего из элементов.
Обозначение степени окисления атома при символе элемента занимает место правого верхнего индекса, но в формуле сложного вещества - может ставиться и над символом соответствующего элемента. Уметь определять степень окисления атома в сложном веществе особенно важно в тех случаях, когда атомы элементов могут иметь несколько степеней окисления, например:.
Если в аналогичных соединениях атомы одного элемента имеют разную степень окисления, то ее обозначение используется в названиях этих сложных веществ более подробно об этом в следующей главе :. Пероксид водорода H 2 O 2 старое название - перекись водорода. Чистый пероксид водорода - бесцветная вязкая жидкость, иногда взрывающаяся без видимых причин. Температура плавления 0 o С, температура кипения o С.
С водой пероксид водорода смешивается во всех отношениях. Водные растворы пероксида водорода более устойчивы, но на свету это вещество медленно разлагается на воду и кислород даже в растворе. Пероксид водорода значительно более реакционноспособен, чем вода, что связано с наличием в его молекуле слабых связей O- O. Применяется в лабораторной практике и промышленности. В медицине используется как кровоостанавливающее и антисептическое средство каждый минимальный аптечный набор должен содержать пузырек с " перекисью".
Благодаря своим отбеливающим свойствам, Н 2 О 2 входит в состав некоторых жидких отбеливателей. Определите степени окисления атомов, входящих в состав каждого из этих соединений. Определите степени окисления атомов : а углерода в гексахлорэтане и этане. Определите высшую и низшую степени окисления атомов элементов третьего периода. Приведите примеры соединений. Как вы думаете, для каких из этих оксидов простейшая формула может не совпадать с молекулярной?
Как вы думаете, каков тип связи в каждом из этих оксидов? Составление шаростержневых моделей молекул. Простейшие окислительно-восстановительные реакции. Валентность W - число химических связей, образуемых атомом. Ковалентность W к - число ковалентных связей, образованных атомом.
Электровалентность W э - абсолютная величина формального заряда атома. Валентное состояние - состояние электронной оболочки атома перед образованием связи. Степень окисления атома : 1 тот заряд, который приобрел бы атом в молекуле в кристалле , если бы все связи в ней в нем стали ионными; 2 тот заряд, который приобрел бы атом в молекуле в кристалле , если бы все электронные пары полярных ковалентных связей полностью сместить в сторону более электроотрицательных атомов, а электронные пары неполярных связей поделить между связываемыми атомами пополам.
Для того, чтобы мы могли качественно предоставить Вам информацию, мы используем cookies, которые сохраняются на Вашем компьютере сведения о местоположении; ip-адрес; тип, язык, версия ОС и браузера; тип устройства и разрешение его экрана; источник, откуда пришел на сайт пользователь; какие страницы открывает и на какие кнопки нажимает пользователь; эта же информация используется для обработки статистических данных использования сайта посредством интернет-сервисов Google Analytics и Яндекс.
Отключить cookies Вы можете в настройках своего браузера. Поиск по серверу. Жуков Химия класс [предыдущий раздел]. Диаграмма валентных подуровней атома. Примеры веществ и примечания. Соединений не существует. Li- Li, молекула очень неустойчива. Дополнительного выигрыша в энергии нет. Cl- Be- Cl Энергия, затраченная на возбуждение, компенсируется образованием двух ковалентных связей. Склонность к отдаче электронов низкая. Предпринимались попытки получить некоторые из этих элементов кроме и , однако они успехом не увенчались.
Проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии [2].

Наиболее распространёнными являются три формы таблицы Менделеева: «короткая» короткопериодная , «длинная» длиннопериодная и «сверхдлинная».
В «сверхдлинном» варианте каждый период занимает ровно одну строчку. Такая расширенн ая периодическая таблица элементов была предложена в году Теодором Сиборгом.
В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. Водород помещён в ю группу таблицы. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по две строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Водород помещён в 7-ю группу таблицы. Короткая форма таблицы была официально отменена ИЮПАК в году, но ее продолжают иногда использовать. Существует несколько сотен вариантов таблицы, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона.
Например, Нильс Бор разрабатывал лестничную пирамидальную форму периодической системы. Многие учёные до сих пор предлагают всё новые варианты таблицы [3] [4]. Группа, или семейство — одна из колонок периодической таблицы.
Для групп, как правило, характерны более выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках.
Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличения атомного числа. Впрочем, в некоторых областях таблицы, например, в d-блоке и f-блоке, горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные.
В соответствии с международной системой именования группам присваиваются номера от 1-го до го в направлении слева направо — от щелочных металлов к благородным газам. Ранее для их идентификации использовались римские цифры.
Изменение свойств элементов в зависимости от положения в периодической таблице Менделеева. Стрелки указывают на повышение. Некоторым из этих групп были присвоены тривиальные, несистематические названия например, «щёлочноземельные металлы», «галогены» и т. Группы с третьей по четырнадцатую включительно такими именами не располагают, и их идентифицируют либо по номеру, либо по наименованию первого представителя «титановая», «кобальтовая» и так далее , поскольку они демонстрируют меньшую степень сходства между собой или меньшее соответствие вертикальным закономерностям.
Элементы, относящиеся к одной группе, как правило, демонстрируют определённые тенденции по атомному радиусу, энергии ионизации и электроотрицательности.
По направлению сверху вниз в рамках группы радиус атома возрастает чем больше у него заполненных энергетических уровней, тем дальше от ядра располагаются валентные электроны , а энергия ионизации снижается связи в атоме ослабевают, и, следовательно, изъять электрон становится проще , равно как и электроотрицательность что, в свою очередь, также обусловлено возрастанием дистанции между валентными электронами и ядром.
Случаются, впрочем, и исключения из этих закономерностей — к примеру, в группе 11 по направлению сверху вниз электроотрицательность возрастает, а не убывает. Период — строка периодической таблицы. Хотя для групп, как уже говорилось выше, характерны более существенные тенденции и закономерности, есть также области, где горизонтальное направление более значимо и показательно, нежели вертикальное — например, это касается f-блока, где лантаноиды и актиноиды образуют две важные горизонтальные последовательности элементов.
В рамках периода элементы демонстрируют определённые закономерности во всех трёх названных выше аспектах атомный радиус, энергия ионизации и электроотрицательность , а также в энергии сродства к электрону.
В направлении «слева направо» атомный радиус обычно сокращается в силу того, что у каждого последующего элемента увеличивается количество заряженных частиц, и электроны притягиваются ближе к ядру , [9] и параллельно с ним возрастает энергия ионизации чем сильнее связь в атоме, тем больше энергии требуется на изъятие электрона.
Соответствующим образом увеличивается и электроотрицательность. Что касается энергии сродства к электрону, то металлы в левой части таблицы характеризуются меньшим значением этого показателя, а неметаллы в правой — большим за исключением благородных газов. Из-за значимости внешней электронной оболочки атома различные области периодической таблицы иногда описываются как блоки, именуемые в соответствии с тем, на какой оболочке находится последний электрон.
Помимо перечисленных выше, периодическому закону соответствуют и некоторые другие характеристики элементов:. Электронная конфигурация.
Организация электронов демонстрирует определённый повторяющийся периодический образец. Электроны занимают последовательность оболочек, которые идентифицируются числами оболочка 1, оболочка 2 и т.
По мере увеличения атомного числа электроны постепенно заполняют эти оболочки; каждый раз, когда электрон впервые занимает новую оболочку, начинается новый период в таблице. Сходства в электронной конфигурации обусловливают подобие свойств элементов наблюдение за которыми, собственно, и привело к открытию периодического закона.
По мере снижения показателей энергии ионизации, электроотрицательности и энергии сродства к электрону элементы приобретают черты, характерные для металлов, а по мере их возрастания — напротив, для неметаллов. В соответствии с закономерностями для упомянутых характеристик, наиболее ярко выраженные металлы располагаются в начале периода, а неметаллы — в его конце.
В группах, напротив, по мере движения сверху вниз металлические свойства усиливаются, хотя и с некоторыми исключениями из общего правила. Сочетание горизонтальных и вертикальных закономерностей придаёт условной разделительной линии между металлами и неметаллами ступенчатый вид; расположенные вдоль этой линии элементы иногда определяются как металлоиды. Периодическая система Д. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей было предсказано существование неизвестных науке химических элементов, установлено их положение относительно известных в таблице и их свойства.
Позже многие элементы были обнаружены и встали на те места, которые предсказал Менделеев в своей таблице. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Лекции Все статьи Периодическая система химических элементов таблица Менделеева. Периодическая система химических элементов таблица Менделеева. История В середине XIX века многие ученые пытались найти и выстроить некие закономерности среди открытых к тому времени 63 химических элементов. Структура Наиболее распространёнными являются три формы таблицы Менделеева: «короткая» короткопериодная , «длинная» длиннопериодная и «сверхдлинная».
Группы Группа, или семейство — одна из колонок периодической таблицы. Стрелки указывают на повышение Некоторым из этих групп были присвоены тривиальные, несистематические названия например, «щёлочноземельные металлы», «галогены» и т. Стрелки указывают на повышение Элементы, относящиеся к одной группе, как правило, демонстрируют определённые тенденции по атомному радиусу, энергии ионизации и электроотрицательности.
Периоды Период — строка периодической таблицы. Другие периодические закономерности Помимо перечисленных выше, периодическому закону соответствуют и некоторые другие характеристики элементов: Электронная конфигурация.
Значение Периодическая система Д. Структура и границы периодической системы. Химики предложили улучшить таблицу Менделеева. Ru 7 октября