Сильными электролитами являются оба основания, 1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
Сильные электролиты полностью диссоциируются или ионизируются, то есть все молекулы электролита превращаются в ионы. Понятно, что за рамками ЕГЭ тоже существует жизнь Какой бизнес в Грузии самый прибыльный. Химические свойства солей А Какая профессия тебе подходит?
Аррениус назвал электролитической диссоциацией. Для объяснения свойств водных растворов электролитов С. Эта теория объясняла, почему растворы некоторых веществ проводят электрический ток, но не отвечала на вопрос, почему одни вещества являются электролитами, а другие — нет. Более подробно особенности поведения веществ в растворах описал Д. Менделеев, который экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие между молекулами растворенного вещества и молекулами растворителя.
Сущность процесса электролитической диссоциации была объяснена на основании природы химической ионной связи.
Молекула воды имеет не линейную, а угловую форму, при этом на атомах водорода локализованы частичные положительные заряды, а на атоме кислорода — отрицательный заряд. Благодаря этому молекула воды является диполем, на одном конце которого сосредоточен положительный заряд, а на другом — отрицательный. При попадании в воду полярные молекулы воды окружают кристаллы хлорида калия, притягиваясь к катионам калия своими отрицательно заряженными концами, а к анионам хлора — положительно заряженными.
За счёт электростатического взаимодействия молекул воды с ионами катионами калия и анионами хлора связь между ионами ослабевает и разрывается, то есть происходит диссоциация распад электролита. Диполи воды полностью окружают образовавшиеся при распаде ионы, образуя гидратную оболочку. Ионы, окружённые молекулами воды, называются гидратированными. Гидратированные ионы переходят в раствор.
В неводных растворах в качестве диполей может выступать не вода, а другой полярный растворитель, например этанол. В таком случае ионы окружены молекулами растворителя образуют сольватную оболочку и называются сольватированными. Теорию электролитической диссоциации можно представить в виде следующих положений. Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, температуры. В зависимости от значения степени диссоциации различают сильные и слабые электролиты.
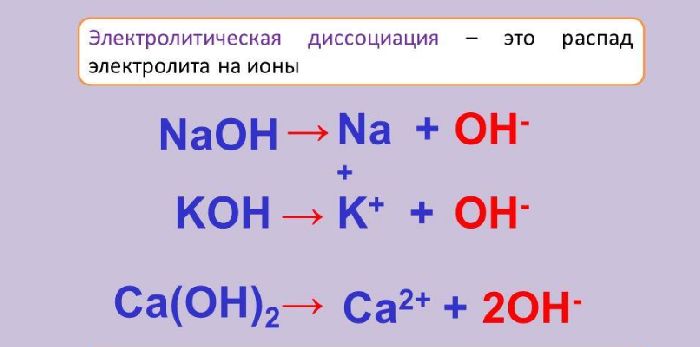
К сильным электролитам относятся:. К слабым электролитам относятся:. Сильный электролит диссоциирует обратимо только в насыщенном растворе, где существует равновесие между кристаллом соли и гидратированными ионами в растворе. Степень диссоциации зависит от природы электролита, природы растворителя и от концентрации электролита.
С уменьшением концентрации электролита при разбавлении раствора степень диссоциации возрастает. Нагревание способствует увеличению степени диссоциации. Многоосновные кислоты диссоциируют ступенчато, т. Например, ступенчатая диссоциация ортофосфорной кислоты может быть выражена тремя уравнениями:.
К числу общих свойств кислот относятся: кислый вкус, способность изменять цвет индикаторов, взаимодействовать с основаниями и основными оксидами с образованием солей и др. К числу общих свойств оснований относятся: мылкость на ощупь, способность изменять цвет индикаторов, взаимодействовать с кислотами и кислотными оксидами с образованием солей и др.
Амфотерные гидроксиды способны проявлять свойства и кислот, и оснований: проявляя кислотные свойства, они способны взаимодействовать с основаниями с образованием солей; проявляя основные свойства, они способны взаимодействовать с кислотами с образованием солей. Средние соли диссоциируют в одну ступень независимо от числа катионов и анионов кислотного остатка.
По способности к диссоциации или, как говорят, «по силе» электролиты разделяют на сильные , средние и слабые. Сила электролита — величина, зависящая от концентрации вещества, температуры, природы растворителя и др.
Самая сильная неорганическая кислота — хлорная НСlО 4. Сила некислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующих элементов:.
Фтороводородная плавиковая кислота HF растворяет стекло, но это вовсе не говорит о ее силе. Эта кислота из бескислородных галогенсодержащих относится к кислотам средней силы из-за высокой энергии связи Н—F, способности молекул HF к объединению ассоциации благодаря сильным водородным связям, взаимодействия ионов F — с молекулами НF водородные связи с образованием ионов и других более сложных частиц. В результате концентрация ионов водорода в водном растворе этой кислоты оказывается значительно пониженной, поэтому фтороводородную кислоту считают средней силы.

Фтороводород реагирует с диоксидом кремния, входящим в состав стекла, по уравнению:. Фтороводородную кислоту нельзя хранить в стеклянных сосудах. Для этого используют сосуды из свинца, некоторых пластмасс и стекла, стенки которых покрыты изнутри толстым слоем парафина.
Если для «травления» стекла использовать газообразный фтороводород, то поверхность стекла становится матовой, что используется для нанесения на стекло надписей и различных рисунков. Сила однотипных кислородных кислот изменяется в противоположном направлении, например йодная кислота НIО 4 слабее хлорной кислоты НСlО 4.
Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность. Один объем воды растворяет около двух объемов хлора. Хлор примерно половина его взаимодействует с водой:. Хлороводородная кислота является сильной, в ее водном растворе практически нет молекул HCl. Правильнее уравнение реакции записать так:.

Образующийся раствор называют хлорной водой. Хлорноватистая кислота — быстродействующий окислитель, поэтому ее применяют для отбеливания тканей. При переходе вниз по подгруппе по мере усиления металлических свойств элемента сила гидроксидов возрастает. Растворимые гидроксиды главной подгруппы I группы элементов относят к щелочам.
Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах. Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей. В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот.
Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих. Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов диссоциация почти не идет. Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
Кислая соль Ca HCO 3 2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO 3 - и слабый электролит, поэтому реакция обратима. Происходит с образованием гидроксильных групп OH - и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо. Ведет к образованию катионов металлов или катиона аммония и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень. Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода. Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH -. С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы.
Полные ионные уравнения отражают реакцию диссоциации, т. Но в таком виде расписывают только сильные электролиты. Сульфат свинца PbSO 4 мы не будем раскладывать на ионы, поскольку это слабый электролит. Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции. В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов она всегда равна 0.
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:. При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.

Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью. Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция. Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Чем электролиты отличаются от неэлектролитов?
Приведите примеры тех и других веществ.